Belajar Kimia yuk! Mengenal konfigurasi elektron pada suatu atom yang merupakan turunan berdasarkan kulit atau orbit. Jadi elektron dalam atom, bisa juga diungkapkan dengan diagram curah hujan dan diagram orbital loh guys. Keduanya bisa bermanfaat saat akan tentukan molekul dan teori guys, seperti yang dikatakan oleh Baston pasaribu pada e-Modul Kimia Kelas X yang disusun oleh beliau, dan diterbitkan oleh Kemdikbud.
Dilihat dari berbagai konfigurasi dapat kita ketahui berbagai golongan dan juga periode dari suatu atom. Dimana golongan tersebut diperlihatkan oleh jumlah elektron terluar, atau biasa disebut dengan elektron valensi. Periode ditampilkan sebagai nomor kulit terbesar pada isi elektron, yang biasa disebut dengan kulit terluar.
Bagi kamu yang masih duduk di bangu tingkat SLTA, yuk kita belajar asik dengan mengenal lebih dalam tentang konfigurasi sebuah elektron.
Bagaimana Cara Menentukan Konfigurasi Elektron?
Menentukan konfigurasi elektron dapat ditentukan dengan menggunakan rumus, yang ditentukan oleh para ilmuwan. Mereka telah meneliti sebuah elektron, yang terdapat sebuah konfigurasi didalam sebuah atom. Sehingga ditemukannya berbagai definisi untuk menerangkan arti dari sebuah konfigurasi elektron, serta bagaimana cara menentukannya.
Para ilmuwan yang menjadi satu kesatuan yang bekerja sama dalam meneliti ilmu tentang reaksi kimia, terhadap sebuah elektron yang terdapat di dalam atom. Diantaranya seperti Neils Nohr, Friedrich Hund, Wolfgang Pauli dan yang lainnya. Berikut merupakan penjelasan dari para ahli bagaimana cara menentukan konfigurasi elektron.
Baca juga: Pengertian Startup Menurut Para Ahli dan Contohnya
Konfigurasi Elektron Menurut Para Ahli & Contohnya yang Harus Kamu Tahu
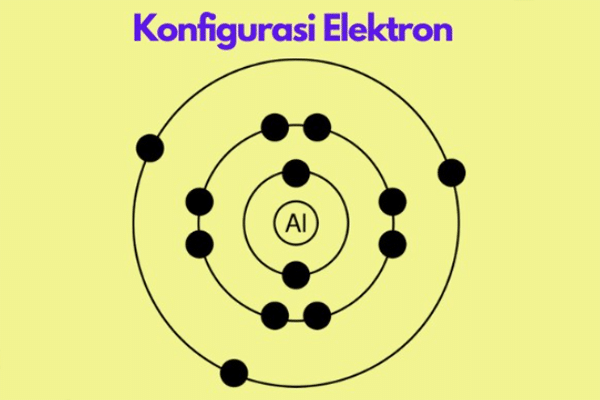
Berbagai macam teori tentang elektron yang berhubungan dengan atom, telah terdefinisi oleh berbagai ilmuwan. Konfigurasi pada sebuah elektron dengan Inti yang sama namun dengan prinsip yang berbeda, tentunya berbagai macam teori tentang atom dapat kamukan di buku buku pelajaran SLTA. Pada pelajaran kimia yang membahas materi Konfigurasi elektron, seperti beberapa teori terkemuka ini.
1. Teori Atom Bohr (Kulit)

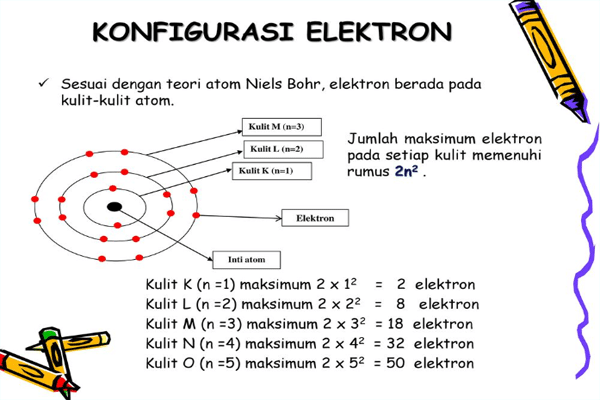
Teori atom bohr menyatakan bahwa berbagai lintasan elektron disebut juga dengan kulit elektron, yang ditempati oleh jumlah elektron maksimal.
Pada teori atom bohler mendefinisikan bahwa sebuah konfigurasi elektron adalah pengisian elektron yang dimulai dari tingkat energi, atau yang dimaksud dengan lapisan kulit paling rendah. Kulit yang pertama disimbolkan dengan kulit K, setelah kulit K sudah terisi penuh. Kemudian dilanjutkan ke kulit L, lalu kulit M, serta kulit N, dan lapisan lapisan kulit selanjutnya.
Setiap kulit elektron tentunya menempati Jumlah elektron maksimal , sehingga bisa ditentukan dengan menggunakan rumus.
2n2
n = Lapisan kulit
Contoh
| Lapisan | Elektron Maksimal |
| K (n = 1) | 2 |
| L (n = 2) | 8 |
| M (n =3) | 16 |
| N (n = 4 ) | 32 |
Jadi guys jika kamu ingin menuliskan konfigurasi elektron suatu atom, maka kamu terlebih dahulu harus mengetahui jumlah elektron. Dimana jumlah suatu atom akan ditunjukkan melalui sebuah nomor atom.
2. Teori Mekanika Kuantum (Subkulit)

Elektron pada sebuah atom, yang bergerak mengelilingi inti kulit atom. Setiap lapisan kulit atom terdapat subkulit didalamnya, berisikan sebuah bilangan kuantum berisikan kumpulan orbital s, p, d, dan f. Memudahkan kamu untuk menentukan nilai bilangan kuantum, dengan menggunakan sebuah diagram orbital.
Diagram orbital dilambangkan dengan sebuah kotak, yang dimaksudkan sebagai tanda untuk sebuah orbital. Seperti yang dihadirkan dalam bentuk tabel berikut.
| Sub Kulit | Kotak |
| s | 1 |
| p | 3 |
| d | 5 |
| f | 7 |
Di sebuah model mekanika kuantum, penulisan yang dilakukan pada suatu konfigurasi sebuah elektron dengan menggunakan diagram orbital. Perlu mengikuti sebuah peraturan untuk menentukan konfigurasi elektron berdasarkan orbital, pada kedudukan elektron terluar dari suatu atom bisa ditentukan melalui bilangan kuantum tersebut.
Baca juga: Sistem Pencernaan Manusia, Berikut Fungsi & Cara Menjaganya
Model mekanika kuantum memiliki empat bagian yang terbagi dalam bilangan kuantum, yang menjelaskan letak dari elektron-elektron suatu atom. Bilangan tersebut terdiri dari :
- n = kuantum utama (Tingkatan energi elektron).
- l = azimuth (Jenis orbital pada sub kulit)
- m = magnetik (posisi orbital pada sub kulit).
- s = spin
Penentuan konfigurasi dari berbagai aturan, dimana sebuah elektron ditentukan berdasarkan orbitalnya. Begitu juga orbital yang memiliki beberapa asas, yang memiliki sebuah masing masing masing peraturan. Asas tersebut terdiri atas tiga bagian, yang dijelaskan secara terperinci pada setiap asasnya sebagai berikut.
- Asas Aufbau – pengisian elektron dimulai dari subkulit dengan tingkat energi paling rendah.
- Asas larangan Pauli – Setiap orbital diisi maksimum 2 elektron dengan spin yang berlawanan.
- Kaidah Hund – pengisian elektron pada orbital memiliki tingkat energi yang sama harus terdistribusikan secara merata.
Peraturan dari sebuah pernyataan yang memiliki kerangka teori menjadi sebuah pedoman, agar penggunaan teori tersebut dapat terdeskripsi secara jelas. Begitu pula kerangka teori, yang dimiliki oleh konfigurasi elektron di dalam sebuah atom pada suatu reaksi kimia.
3. Aturan Setengah Penuh
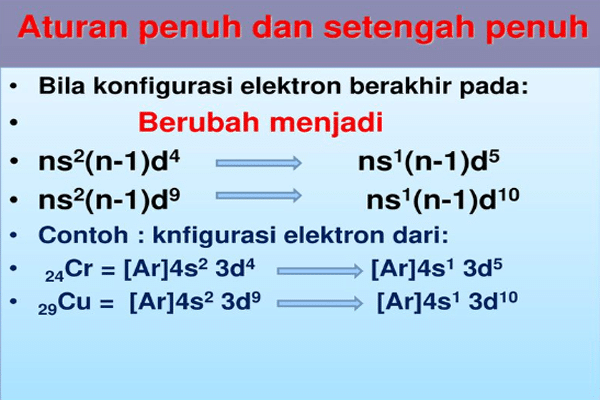
Aturan ini merupakan sebuah ketentuan, pada keterkaitan dengan stabilisasi suatu unsur. Beberapa unsur suatu elektron cenderung dapat mengalami perpindahan sebuah orbital, agar bisa lebih stabil. Keadaan ini sangat memungkinkan untuk terjadi pada orbital. seperti contoh yang terjadi pada unsur 24Cr berikut.
24Cr = 1s2 2s2 2p6 3s2 3p6 4s2 3d4
Apabila dilakukan konfigurasi seperti contoh di atas, unsur 24Cr akan memiliki sifat kurang stabil. Unsur tersebut akan stabil apabila orbital dapat terisi setengah penuh, misalnya 5 orbital terisi dengan ketentuan maksimal penuh dengan 10 elektron). Maka konfigurasi tersebut akan mengikuti aturan setengah penuh seperti yang terjadi pada konfigurasi elektron berikut ini.
24Cr = 1s2 2s2 2p6 3s2 3p6 4s1 3d5
Jadi begini guys, ternyata pada salah satu elektron yaitu orbital s akan dipindahkan ke orbital d agar terdapat unsur yang bisa lebih stabil.
4. Konfigurasi Elektron Gas Mulia
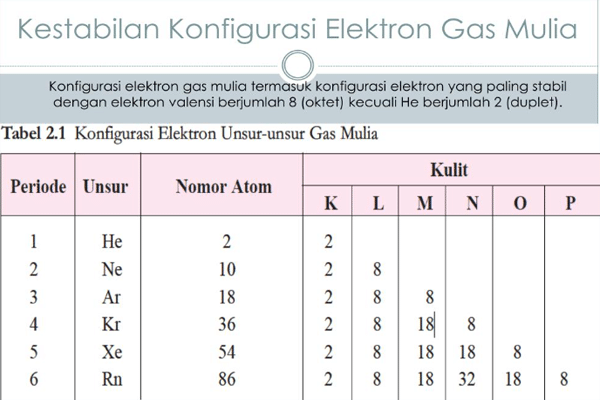
Berikutnya konfigurasi elektron pada suatu gas mulia, dimana gas ini terdapat pada golongan VIIIA yang cukup stabil, sehingga sulit untuk melakukan reaksi dengan unsur lain. Golongan unsur gas mulia memiliki berbagai unsur yang terdiri dari He (helium), Ne (neon), Ar (argon), Kr (kripton), Xe (xenon), dan Rn (radon). Dimana gas mulia tersebut dapat dikonfigurasikan sebagai berikut.
- 2He = 1s2
- 10Ne = 1s2 2s2 2p6 = [He] 2s2 2p6
- 18Ar = 1s2 2s2 2p6 3s2 3p6 = [Ne] 3s2 3p6
- 36Kr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 = [Ar] 4s2 3d10 4p6
- 54Xe = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 = [Kr] 5s2 4d10 5p6
- 86Rn = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 = [Xe] 6s2 4f14 5d10 6p6
Itulah berbagai macam berbagai macam konfigurasi elektron yang bisa kamu pelajari, dengan memperdalami konfigurasi elektron dapat membuat kamu memahami dasar dasar konfigurasi elektron. Itu lah penjelasan dari berbagai pembahasan tentang konfigurasi elektron dari sebuah atom, semoga kamu bisa memanfaatkan berbagai macam pembahasan menarik.
Baca juga: Sistem Pencernaan Manusia, Berikut Fungsi & Cara Menjaganya